Dolor en endometriosis (Revisión)
Por Jessica Madden y colaboradores
Publicado en frontiers in cellular neuroscience
Octubre 2020
doi: 10.3389 / fncel.2020.590823
Resumen y traducción Jaime Barrios Nassi
La endometriosis es una enfermedad crónica y debilitante que afecta aproximadamente al 10% de las mujeres.
La endometriosis se caracteriza por infertilidad y dolor pélvico crónico, pero las opciones de tratamiento siguen siendo limitadas.
En muchos aspectos, esto está relacionado con una falta subyacente de conocimiento de la etiología y los mecanismos que contribuyen al dolor inducido por endometriosis.
Si bien muchos estudios se centran en la menstruación retrógrada y la formación y desarrollo de lesiones en la patogenia de la endometriosis, los mecanismos subyacentes al dolor asociado son inciertos.
Aquí revisamos la evidencia clínica y experimental reciente de los mecanismos que contribuyen al dolor crónico en la endometriosis. Esto incluye las funciones de inflamación, inflamación neurogénica, neuroangiogénesis, sensibilización periférica y sensibilización central.
Como también se sabe que los pacientes con endometriosis tienen comorbilidades como el síndrome del intestino irritable y el síndrome de vejiga hiperactiva, resaltamos cómo las vías nerviosas comunes que inervan el colon, la vejiga y el aparato reproductor femenino pueden contribuir a la comorbilidad a través de la sensibilización de órganos de manera cruzada.
Palabras clave: dolor pélvico crónico, aferentes sensoriales, útero, vagina, inflamación, neuroangiogénesis, sensibilización periférica, hiperalgesia
INTRODUCCIÓN
La endometriosis es una condición crónica y debilitante caracterizada por dolor pélvico crónico (DPC) e infertilidad.
La endometriosis tiene una gran carga clínica, que afecta aproximadamente a 1 de cada 10 mujeres en todo el mundo (10%) (Simoens et al., 2007; Adamson et al., 2010; Nnoaham et al., 2011). Como tal, la endometriosis está asociada con una carga social y económica significativa que cuesta a la economía de los EE. UU. $ 22 mil millones anuales en productividad perdida y costos directos de atención médica (Simoens et al., 2007; Adamson et al., 2010; Nnoaham et al., 2011).
A pesar de esta carga, la etiología y patogenia de la endometriosis siguen estando mal definidas, mientras que las intervenciones terapéuticas eficaces siguen siendo limitadas.
La endometriosis se diagnostica quirúrgicamente por la presencia de lesiones endometriales fuera del útero. Sin embargo, la intervención quirúrgica y el diagnóstico suelen estar precedidos por episodios de dolor abdominal crónico y / o Dolor Pélvico Crónico (DPC), lo que lleva a los pacientes a acudir a su médico.
Más del 60% de las mujeres diagnosticadas con endometriosis informan DPC, y las pacientes con endometriosis tienen 13 veces más probabilidades de experimentar dolor abdominal que las personas sanas (Ballard et al., 2008). A pesar de esta homogeneidad de la enfermedad, los mecanismos por los cuales la endometriosis induce un estado de dolor crónico siguen siendo poco conocidos (Ballard et al., 2008).
La extirpación quirúrgica de las lesiones endometriales tiene éxito para aliviar el dolor en pacientes con endometriosis, lo que respalda el papel de estas lesiones en el dolor crónico. Sin embargo, existe disparidad en la correlación entre la gravedad del dolor y la puntuación de la lesión (Porpora et al., 1999). Además, el dolor crónico reaparece con frecuencia en los pacientes dentro de los 12 meses posteriores a la eliminación de la lesión, incluso en ausencia de regeneración de la lesión (Abbott et al., 2004; Shakiba et al., 2008).
Existe una clara desconexión entre la teoría tradicional de que el dolor asociado a la endometriosis depende únicamente de las lesiones y la realidad que experimentan los pacientes con endometriosis en todo el mundo. Esta desconexión se destaca aún más por la observación de que los pacientes con endometriosis con frecuencia padecen una serie de comorbilidades clínicas.
La endometriosis comúnmente se diagnostica conjuntamente con trastornos de la vejiga y el colon que se caracterizan por una disfunción sensorial, como el síndrome de vejiga hiperactiva (VH) y el síndrome del intestino irritable (SII) (Surrey et al., 2018). Estas comorbilidades sugieren una fisiopatología más compleja del dolor inducido por la endometriosis que no puede explicarse por las lesiones endometriales por sí solas.
La creciente evidencia ahora indica que una remodelación crónica del sistema nervioso ocurre en las vías neuronales sensoriales compartidas para inducir un estado de sensibilización periférica y central prolongada y dolor crónico en pacientes con endometriosis.
En esta revisión, resumimos la investigación clínica y preclínica más reciente para destacar los avances en la determinación de los mecanismos subyacentes al desarrollo de la DPC asociada a la endometriosis y el dolor abdominal crónico. En particular, destacamos los mecanismos que ocurren en la periferia.
Patogénesis
Como trastorno dependiente de estrógenos, la endometriosis afecta predominantemente a mujeres en edad reproductiva de entre 15 y 50 años (Giudice y Kao, 2004).
La endometriosis es una condición inflamatoria crónica, caracterizada por la migración de células endometriales uterinas hacia la cavidad pélvica, donde forman lesiones en múltiples sitios en múltiples órganos.
La menstruación retrógrada es el mecanismo generalmente aceptado que subyace a la patogenia de la endometriosis (Sampson, 1927; Giudice y Kao, 2004). Este mecanismo fue propuesto originalmente en 1927, mediante el cual los fragmentos de endometrio migran desde las trompas de Falopio hacia la cavidad peritoneal durante la menstruación
(Observado a través de mi experiencia en cirugías, trompas dilatadas y tortuosas regurgitando sangrado menstrual - Jaime Barrios Nassi)
Sin embargo, la menstruación retrógrada ocurre naturalmente en el 90% de las mujeres, pero solo el 10% de las mujeres desarrollan endometriosis (Halme et al., 1984b). Los datos más recientes muestran que la prevalencia de la menstruación retrógrada no es diferente en mujeres con o sin endometriosis, lo que sugiere una etiología más compleja (Kruitwagen et al., 1991; O et al., 2017).
Las pacientes con endometriosis suelen tener volúmenes más altos y frecuentes de flujo menstrual, intervalos de ciclo menstrual más cortos y un aumento de fragmentos endometriales en la cavidad peritoneal (Liu y Hitchcock, 1986; Tal et al., 2019).
Una vez que los restos endometriales se vuelven ectópicos, es necesario que se produzca la adhesión para iniciar el desarrollo de lesiones y la inducción de endometriosis. Si bien los mecanismos subyacentes a este proceso siguen sin estar claros, se considera que la disfunción inmunitaria y la posterior incapacidad para eliminar de manera efectiva estos fragmentos permite que se formen lesiones endometriales en la cavidad peritoneal (Giudice y Kao, 2004).
La menstruación normal requiere el inicio de una respuesta inmune innata para proporcionar una descomposición cíclica y la eliminación de las células endometriales del útero en un proceso altamente regulado (Critchley et al., 2001). De manera similar, en las mujeres que no desarrollan endometriosis, los restos endometriales ectópicos se eliminan del peritoneo mediante una respuesta inmune innata caracterizada por un aumento de neutrófilos, macrófagos, células asesinas naturales (NK) y células dendríticas (O et al., 2017; Symons et al., 2018).
La desregulación en esta respuesta inmune innata en respuesta al tejido endometrial ectópico se ha implicado en la patofisiología de la endometriosis.
Numerosos estudios han mostrado un aumento de macrófagos peritoneales en respuesta a la infiltración de monocitos circulantes en la cavidad peritoneal (Halme et al., 1984a; Amaral et al., 2006; Banu et al., 2008), que facilitan el crecimiento de endometrio. tejido (Oosterlynck et al., 1992; Dmowski et al., 1998; Chuang et al., 2010).
En las mujeres sin endometriosis, la regulación y el control estrictos de las células inmunitarias allanan el camino para el próximo ciclo menstrual. Sin embargo, en mujeres con endometriosis, el medio inflamatorio crónico se ha relacionado con la generación de dolor (Laux-Biehlmann et al., 2015).
Aunque la menstruación retrógrada es el mecanismo más antiguo y más ampliamente aceptado, se han propuesto otras teorías en la patogenia de la endometriosis.
Entre estos, la metaplasia de células especializadas en el tejido peritoneal en células similares al endometrio (metaplasia celómica), el desequilibrio hormonal, la resistencia a la progesterona, la disfunción inmunológica y la inflamación, pueden facilitar el crecimiento de la lesión y un componente genético que proporciona un sesgo hacia los parientes de primer grado y gemelos (Sourial et al., 2014).
Comprender la patogenia de la endometriosis y cómo cada uno de estos mecanismos puede entrelazarse es un área importante de investigación.
El esclarecimiento de los factores y mecanismos de riesgo permitirá una comprensión más amplia del desarrollo de la endometriosis y, en última instancia, el tratamiento y la prevención de la formación y el crecimiento de lesiones ectópicas.
Diagnóstico clínico
Los síntomas más comunes de la endometriosis incluyen dismenorrea, dolor de espalda y dolor abdominal bajo crónico o DPC que se asocia con el llenado de la vejiga y la defecación. Como estos síntomas imitan a los de otras enfermedades o afecciones, el diagnóstico clínico de la endometriosis es complejo (Hickey et al., 2014). A pesar de múltiples estudios destinados a identificar biomarcadores en la sangre o la orina para facilitar las pruebas biológicas no invasivas y el diagnóstico clínico de la endometriosis, hasta el momento no se han identificado biomarcadores (Nisenblat et al., 2016; Chapron et al., 2019).
El examen clínico a través de la palpación del área abdominal y pélvica, junto con la historia del paciente, son etapas tempranas del proceso de diagnóstico de endometriosis, pero son solo pasos para una mayor investigación (Riazi et al., 2015).
El examen clínico no puede diagnosticar definitivamente la endometriosis. El ultrasonido, la investigación no invasiva más común, sólo identifica correctamente alrededor del 10% de los casos (Pugsley y Ballard, 2007).
Los avances recientes en imágenes médicas sugieren el potencial de la ecografía transvaginal y la resonancia magnética como herramientas de diagnóstico para algunos tipos de endometriosis; sin embargo, la identificación de lesiones peritoneales superficiales aún no es posible ya que el tamaño de las lesiones está por debajo del umbral de detección (Guerriero et al. , 2018; Van den Bosch y Van Schoubroeck, 2018; Chapron et al., 2019).
En consecuencia, la endometriosis solo puede diagnosticarse y clasificarse mediante laparoscopia quirúrgica o laparotomía para confirmar la presencia de lesiones endometriósicas (Hickey et al., 2014).
Debido a la naturaleza quirúrgicamente invasiva de estas pruebas de diagnóstico, así como a la comprensión limitada de la patología, la progresión y los factores de riesgo de la endometriosis, a menudo hay diagnósticos erróneos frecuentes y un consiguiente retraso en la determinación del diagnóstico correcto.
Múltiples estudios que investigan el tiempo entre la aparición del dolor y el diagnóstico de endometriosis informan un retraso significativo, con un promedio de 8 años en el Reino Unido y hasta 12 años en muchos países, incluido Estados Unidos (Hadfield et al., 1996; Arruda et al., 2003; Husby et al., 2003; Nnoaham et al., 2011). Es probable que estos retrasos en el diagnóstico contribuyan a la cronicidad progresiva de la enfermedad.
Una vez confirmada quirúrgicamente, el estadio y la extensión de la endometriosis se clasifican mediante un sistema de clasificación mundial estandarizado en uno de cuatro grados, determinados por la gravedad de las lesiones / adherencias (Taf, 1979; Canis et al., 1997). Aunque este es el método estándar y aceptado para clasificación, solo existe una correlación débil entre la gravedad graduada de las características morfológicas y la intensidad y el carácter de los síntomas del dolor (Vercellini et al., 2007; Hsu et al., 2011).
A medida que evoluciona el diagnóstico y la clasificación de la endometriosis, ha quedado claro que se trata de una enfermedad crónica y sistémica con una comprensión inadecuada, y la etapa de diagnóstico no es indicativo del sufrimiento del paciente (Adamson, 2011; Johnson et al., 2017).
La ubicación de las lesiones ectópicas puede variar drásticamente entre pacientes y se encuentran predominantemente en el peritoneo, pero también adheridas a órganos, incluidos los ovarios, la vagina, las trompas de Falopio, la vejiga, el colon y el intestino delgado (Chapron et al., 2003; Stegmann et al. , 2008). Si bien el dolor a menudo se experimenta en los órganos reproductores, el dolor también puede originarse en esos órganos de cercana proximidad , como el intestino y la vejiga.
En consecuencia, los pacientes con endometriosis exhiben una comorbilidad significativa con dolor abdominal crónico y trastornos de DPC como cistitis intersticial / síndrome de vejiga dolorosa (70-80% de los pacientes con endometriosis) (Chung et al., 2005; Tirlapur et al., 2013) e IBS ( 50-70% de los pacientes con endometriosis) (Jess et al., 2012; Schomacker et al., 2018).
Aunque las lesiones se pueden extirpar o cauterizar como tratamiento inicial para el DPC asociada a endometriosis, a menudo se requieren tratamientos adicionales o cirugía adicional. Si bien la cirugía, los agentes farmacéuticos hormonales y no hormonales (que se describen en mayor detalle a continuación) se utilizan para tratar de resolver la DPC (Tabla 1), rara vez es posible la erradicación completa del dolor asociado con la endometriosis.
MECANISMOS SUBYACENTE AL DOLOR INDUCIDO POR ENDOMETRIOSIS
La mayor parte de la investigación sobre los mecanismos subyacentes al dolor en la endometriosis se ha centrado en las lesiones y adherencias endometriales como la principal fuente de dolor asociado a la endometriosis.
Aunque el dolor específico de la lesión es evidente e indudablemente esencial para la inducción del dolor inducido por endometriosis, la extirpación de la lesión no proporciona alivio del dolor en todos los casos, con informes que sugieren que 20-28% de las pacientes no experimentan alivio del dolor después de la cirugía (Sutton et al. , 1994; Abbott et al., 2004). Además, solo existe una asociación marginal entre la etapa de endometriosis (definida por la morfología de la lesión) y la gravedad de los síntomas pélvicos (Vercellini et al., 2007), lo que sugiere que están involucrados mecanismos complejos adicionales.
La comprensión más reciente de los mecanismos subyacentes al desarrollo de un estado de dolor crónico en la endometriosis implica el sangrado cíclico de las lesiones y la inflamación subsiguiente en ambos sitios de la lesión y en la cavidad peritoneal.
Estas respuestas proinflamatorias luego dan como resultado la activación de los nervios sensoriales y la activación alterada de las vías nociceptivas (Tabla 2) (Morotti et al., 2017; Patel et al., 2018; Zheng et al., 2019).
Inflamación
En el útero, la descomposición y eliminación natural del tejido endometrial durante la menstruación es una respuesta altamente regulada a la caída de los niveles de estrógeno y progesterona, que actúa para eliminar los desechos menstruales del útero y dar paso a otro ciclo de regeneración endometrial (Berbic y Fraser, 2013). Se realiza por el sistema inmunológico innato, este proceso recluta una gran cantidad de células inmunitarias, incluidos neutrófilos, macrófagos y células asesinas naturales (NK) para facilitar la descomposición menstrual.
El revestimiento del endometrio sufre apoptosis y necrosis y finalmente se desprende (Berbic y Fraser, 2013). La muerte celular programada durante la menstruación libera numerosos productos celulares, que incluyen hierro, especies reactivas de oxígeno (ROS), prostaglandinas y una familia de patrones moleculares asociados al daño (DAMP), entre otros (Laux-Biehlmann et al., 2015). Cuando ocurre la menstruación retrógrada, los fragmentos de endometrio se adhieren y forman lesiones dentro del peritoneo, donde permanecen en un estado parecido al del endometrio, expresando receptores de estrógenos y sufriendo eventos inflamatorios y menstruales cíclicos.
(Brosens, 1997; Burney y Lathi, 2009).
El sangrado cíclico en respuesta a las hormonas sexuales, que ocurre naturalmente en el útero durante la menstruación, también se puede observar dentro de la cavidad peritoneal en el sitio de las lesiones endometriales (Halme et al., 1984a).
En la endometriosis, los subproductos menstruales también surgen de lesiones extrauterinas y se liberan en la cavidad peritoneal donde inician respuestas inmunes (Tabla 2 y Figura 1) (Laux-Biehlmann et al., 2015).
El intento de descomposición de las lesiones endometrióticas existentes y la menstruación retrógrada residual en la cavidad peritoneal no solo activa una respuesta inmune, sino que el medio inflamatorio amplificado conduce a una acumulación de hierro, ROS, prostaglandina E2 (PGE2) y acidosis (Reeh y Steen , 1996).
Esta respuesta inmunitaria es evidente en los sitios de la lesión, con un aumento de citocinas / quimiocinas inflamatorias, factores de crecimiento, neutrófilos y prostaglandinas que se encuentran dentro de la cavidad peritoneal de pacientes con endometriosis (Donnez et al., 1998; Barcz et al., 2000; Sacco et al., 2012; Králíèková y Vetvicka, 2015). De estos mediadores, PGE2, factor de necrosis tumoral-α (TNFα), factor de crecimiento nervioso (NGF), células T normales reguladas en la activación expresadas y secretadas (RANTES, también conocido como ligando de quimiocinas CC 5: CCL5) e interleucina (IL) IL-8 e IL-1β están todas elevadas en el líquido peritoneal de pacientes con endometriosis que informaron dolor de DPC (Ryan et al., 1995; Barcz et al., 2000; Bedaiwy et al., 2002; Scholl et al., 2009) . Fundamentalmente, todos estos mediadores pueden activar directamente las terminaciones nerviosas sensoriales, lo que sugiere que los mecanismos inflamatorios pueden ser importantes en la endometriosis asociada (Wu et al., 2017; Liang et al., 2018).
Un estudio reciente mostró que el análisis de citocinas de los fluidos peritoneales podría diferenciar a las mujeres diagnosticadas y estratificadas por laparoscopia con endometrioma ovárico, endometriosis peritoneal o endometriosis infiltrante profunda. Esto sugiere que ciertas citocinas podrían estar impulsando diferentes eventos de señalización biológica y respuestas inmunes en estos pacientes (Zhou et al., 2020).
Además, las ROS inducen la modificación oxidativa de proteínas y se encuentran niveles significativamente más altos de marcadores de estrés oxidativo de proteínas en el líquido peritoneal de mujeres con endometriosis (Santulli et al., 2015).
La selección de proteínas oxidadas con antioxidantes orales, incluidas la vitamina E y la vitamina C, reduce significativamente el dolor crónico informado en mujeres con endometriosis en comparación con el placebo después de 8 semanas de tratamiento (Santanam et al., 2013).
Este enfoque de tratamiento también disminuyó los marcadores inflamatorios dentro del líquido peritoneal (Santanam et al., 2013). Se ha sugerido que las proteínas oxidadas y la activación posterior de los nociceptores promueven el dolor asociado a la endometriosis, aunque el mecanismo subyacente sigue sin estar claro (Ray et al., 2015; Wright et al., 2017).
En general, el aumento resultante de detritos extrauterinos, acentuado por una menstruación retrógrada adicional, induce una respuesta inflamatoria mejorada dentro del peritoneo y presenta una oportunidad para que la interacción de estas células inmunes con los nervios sensoriales induzca CPP (Asante y Taylor, 2011).
Se propone la exposición a largo plazo a citocinas proinflamatorias para activar y sensibilizar los nervios sensoriales presentes en las lesiones endometriósicas, iniciando la transferencia del dolor al sistema nervioso central (SNC) (Laux-Biehlmann et al., 2015).
La activación de las fibras nerviosas sensoriales para generar y transmitir dolor al SNC es un paso vital en la vía de procesamiento del dolor y contribuye a otras formas de dolor visceral crónico (Berkley, 2005; Brierley y Linden, 2014; de Groat et al., 2015; Grundy y Brierley, 2018). Si bien esta inflamación cíclica puede exacerbar el dolor durante la menstruación, muchas mujeres con endometriosis también experimentan dolor no cíclico (Vercellini et al., 2007). Esto sugiere que otros mecanismos, independientes de los eventos cíclicos, contribuyen a la CPP en la endometriosis.
Neuroangiogénesis
El dolor depende de la existencia de vías de transducción sensorial que unen los estímulos periféricos a la médula espinal para su procesamiento y al cerebro para la percepción (Figura 2). Sin embargo, los fragmentos de endometrio no tienen una inervación sensorial intrínseca conectada a estas vías.
Para que las lesiones endometriales induzcan dolor crónico, es necesario que ocurra el desarrollo de nuevos nervios sensoriales para transmitir estas señales. Varios estudios han demostrado que una vez que los fragmentos endometriales se adhieren a una ubicación peritoneal y se convierten en lesiones, sufren un proceso de neuroangiogénesis (Asante y Taylor, 2011). Consiste en el establecimiento coordinado de un suministro de sangre a través de la generación de nuevos vasos sanguíneos para apoyar el crecimiento y la supervivencia (angiogénesis), junto con la inervación sincronizada por fibras nerviosas (neurogénesis) (Weinstein, 2005).
La neuroangiogénesis está regulada por los estrógenos y las células inmunitarias, incluidos los macrófagos, que son una fuente importante de factor de crecimiento endotelial vascular (VEGF) y factor de crecimiento nervioso (NGF), ambos aumentados en la endometriosis (McAllister et al., 2009; Greaves et al. al., 2014). Los macrófagos exacerban la inflamación local, facilitan el crecimiento de las lesiones endometriales ectópicas y participan directamente en la angiogénesis, liberando quimiocinas y citocinas que impulsan aún más el crecimiento del tejido endometrial (Hammond et al., 1993; Lin et al., 2006; Bulun, 2009). En un modelo de ratón con endometriosis trasplantado quirúrgicamente, la secreción de macrófagos de los factores angiogénicos VEGF, TNFα y macrófagos inflamatorios aumento la inervación de las fibras nerviosas (Mechsner et al., 2009; McKinnon et al., 2012).
Un aumento en los marcadores neuroangiogénicos se ha relacionado con una inervación densa en las lesiones y está estrechamente relacionado con los síntomas de CPP en mujeres que padecen endometriosis (Kajitani et al., 2013; Morotti et al., 2014).
Los marcadores de neuronas adrenérgicas y colinérgicas (neuropéptido Y), así como de fibras C amielínicas (sustancia P: SP, péptido relacionado con el gen de la calcitonina: CGRP) son significativamente más altos en el endometrio de pacientes con endometriosis (Kajitani et al., 2013) ).
También se observan niveles elevados de neurotrofinas y sus receptores, incluido el NGF y su receptor tirosina quinasa A (TrkA), en biopsias endometriales de mujeres con endometriosis (Tokushige et al., 2008).
NGF promueve el brote de nuevos nervios y actúa directamente sobre las fibras nerviosas sensoriales existentes para inducir dolor (Anaf et al., 2002; Chao, 2003). Estos efectos se ven agravados por el aumento de los niveles de estrógeno circulante en mujeres con endometriosis, ya que el estrógeno puede potenciar la activación del NGF de TrkA (Bjorling et al., 2002). Esto es importante ya que siguiendo la reacción el miembro 1 de la subfamilia V del receptor transitorio del canal catiónico nociceptivo (TRPV1), que se ha encontrado que está regulado al alza en endometriomas y células endometriales ectópicas (Wang, 2008; Bohonyi et al., 2017). ).
Un aumento en la densidad de las terminaciones nerviosas a lo largo de las lesiones y una mayor excitabilidad de los nervios proporciona la base para una mayor nocicepción en los sitios de la lesión.
También se ha encontrado que la proteína 1 inducida por lesión nerviosa (Ninj1), que promueve el crecimiento de neuritas, se expresa en tejidos endometrióticos ováricos y peritoneales (Miyashita et al., 2019).
Junto con el establecimiento y crecimiento de las lesiones endometriales, la neuroangiogénesis ayuda a la irritación e invasión de los nervios existentes.
La densidad nerviosa aumenta en los nódulos endometriósicos infiltrantes profundos en comparación con el tejido vaginal sano, una observación que también se observa en las lesiones endometrióticas peritoneales en relación con el peritoneo normal (Tokushige et al., 2006b; Wang et al., 2009b; Anaf et al., 2011). ).
La estrecha proximidad de las adherencias endometriales y las lesiones a los nervios pélvicos puede provocar su encapsulación o compresión, lo que contribuye a la DPC asociada con la endometriosis (Tulandi et al., 2001).
La hiperalgesia debida a la inervación y la encapsulación densa está respaldada por múltiples estudios, que muestran que la puntuación más alta de dolor en pacientes con endometriosis se correlaciona con una mayor densidad de nervios y encapsulaciones nerviosas (Anaf et al., 2000; Mechsner et al., 2009; McKinnon et al., 2009). al., 2012).
También se ha sugerido que un desequilibrio entre la activación de los canales iónicos antinociceptivos y pro nociceptivos en estas neuronas que inervan la lesión es un posible mecanismo de la fisiopatología del dolor (Arnold et al., 2012). Estos desequilibrios también contribuyen a otras condiciones de dolor visceral (Sadeghi et al., 2018). Un desequilibrio que resulte en un aumento de la entrada nociceptiva, con una disminución del control parasimpático en los sitios de la lesión, podría conducir a una mayor respuesta al dolor.
Los cambios en este equilibrio autónomo se producen en una serie de trastornos de dolor visceral crónico que incluyen fibromialgia, enfermedad por reflujo gastroesofágico e IBS (Aziz, 2013), con disminución de la actividad parasimpática y aumento de la actividad simpática (Heitkemper et al., 1998), lo que favorece la transmisión de estímulos dolorosos. .
Los nervios sensoriales tenían una densidad significativamente mayor en áreas cercanas a las lesiones endometrióticas en comparación
a las fibras nerviosas simpáticas (Arnold et al., 2012).
Curiosamente, se ha demostrado que las terapias hormonales tradicionales que alivian el dolor en la endometriosis, incluidos los progestágenos y los anticonceptivos orales, reducen significativamente la densidad de las fibras nerviosas en el endometrio ectópico (Tokushige et al., 2008). Aunque es un hallazgo novedoso, no se evaluó la intensidad del dolor y se necesitan más estudios para determinar si la reducción de las fibras nerviosas en las lesiones endometriales en respuesta a la terapia hormonal mostraría un efecto clínico sobre el dolor específico de la lesión.
En este sentido, se ha demostrado que la expresión del receptor de estrógeno en muestras de endometrio predice la gravedad de los síntomas y la recurrencia del dolor en la endometriosis. En particular, una mayor expresión de ER-α aumentó la posibilidad de dismenorrea moderada a grave y dispareunia profunda. En consecuencia, la terapia con progestina redujo la expresión de ER-α, mientras que el receptor de andrógenos, la expresión de aromatasa y la abundancia del receptor de progesterona no se alteraron (Pluchino et al., 2020).
Inflamación neurogénica
Además del entorno ya pronociceptivo inducido por lesiones endometriales en la cavidad peritoneal, la acumulación de subproductos tisulares degradados, incluidos ROS, PGE2 y la acidificación, puede actuar directamente sobre las fibras nerviosas sensoriales o sensibilizarlas a través de receptores en los nervios aferentes nociceptivos ubicados dentro lesiones
(Tabla 2 y Figura 1) (Reeh y Steen, 1996; Ma y Quirion, 2008; Holzer, 2011). Para agravar este aluvión nociceptivo, las fibras nerviosas sensoriales sensibilizadas mantienen la inflamación mediante un circuito de retroalimentación positiva llamado "inflamación neurogénica". La excitación de estas fibras nerviosas da como resultado que sus terminales liberen más moduladores proinflamatorios. Esto incluye neuropéptidos como SP y CGRP, los cuales se encuentran cerca de las lesiones endometriales en mujeres con dolor asociado a endometriosis (Tokushige et al., 2006a).
Además, la activación de los nervios aferentes sensoriales inicia el reclutamiento de mastocitos y la posterior liberación de citocinas proinflamatorias, que incluyen TNFα, NGF, PGE2 y una variedad de interleucinas, como IL-1β, que contribuye a un estado crónico de inflamación neurogénica ( van der Kleij et al., 2009; Chiu et al., 2012). Esta inflamación fomenta una mayor estimulación de los mastocitos y macrófagos que circulan localmente, que se encuentran en niveles elevados y muy cerca de las fibras nerviosas en mujeres con endometriosis (Bacci et al., 2009). Varias otras afecciones de dolor crónico, como asma, artritis, cistitis intersticial, IBS, enfermedad inflamatoria intestinal (EII; incluida la colitis ulcerosa y la enfermedad de Crohn), muestran un estado inflamatorio neurogénico crónico que induce dolor crónico (Bordman y Jackson, 2006; van der Kleij et al., 2009; Brierley y Linden, 2014; Straub y Schradin, 2016).
Sensibilización periférica
La neuroplasticidad de los nervios sensoriales periféricos, de manera que se producen cambios estructurales, sinápticos o intrínsecos para cambiar la función neuronal a un estado más sensibilizado, es un proceso establecido en el desarrollo del dolor visceral crónico (Brierley y Linden, 2014; Grundy et al., 2019) . En circunstancias normales, la sensibilización periférica hace que descienda el umbral de activación neuronal, lo que induce dolor por un estímulo que normalmente no provoca dolor (alodinia) o aumenta el dolor existente (hiperalgesia).
Este mecanismo proporciona protección contra daños adicionales después del desarrollo de inflamación por una lesión existente (Iyengar et al., 2017). Sin embargo, si la inflamación persiste o se produce una mala adaptación a los estímulos sensibilizantes originales, los nociceptores pueden volverse crónicamente hipersensibles incluso después de que la inflamación se resuelve y la histología parece normal. Esta hipersensibilidad periférica de las fibras nociceptivas en los sitios de la lesión puede desempeñar un papel en la alodinia y la hiperalgesia observada en pacientes con endometriosis (Figura 1) (Morotti et al., 2017).
Como se describió anteriormente, hay una abundancia de moléculas inflamatorias, que incluyen glicodelina, ROS, TNFα, NGF y PGE2 en el líquido peritoneal de mujeres con endometriosis, que pueden contribuir a la inducción de un estado más pronociceptivo (Tabla 2) (Chiu et al., 2012; St-Jacques y Ma, 2014).
Los niveles elevados de TNFα y glicodelina se correlacionan con la hiperexcitabilidad central en respuesta a la estimulación eléctrica repetida y la respuesta de dolor alterada al reflejo de abstinencia nociceptiva, así como con niveles más altos de dolor menstrual experimentado por pacientes con endometriosis (Scholl et al., 2009; Neziri et al., 2014). Los pacientes con las puntuaciones de dolor más altas también tenían los niveles más altos de TNFα, que era independiente de la puntuación de la lesión (Overton et al., 1996). Apoyando aún más su papel en las condiciones de dolor crónico, el TNFα activa las fibras nerviosas que inervan el colon y se ha demostrado que está elevado en muestras de pacientes con SII, lo que se correlaciona con las puntuaciones de dolor clínico del paciente (Hughes et al., 2013).
El canal iónico nociceptivo TRPV1 se ha relacionado con otras afecciones de dolor crónico como la artritis reumatoide, la osteoartritis y el SII (Wang, 2008; Basbaum et al., 2009; Sadeghi et al., 2018), actuando como un sensor molecular para potenciar y integran respuestas a estímulos que inducen dolor, como acidosis, estrés oxidativo o mediadores inflamatorios (Tominaga y Julius, 2000; Wang, 2008). Apoyando una participación de TRPV1 en el dolor asociado con la endometriosis, se ha encontrado una expresión elevada de TRPV1 en el ganglio de la raíz dorsal (DRG) de ratas con endometriosis (Lian et al., 2017), así como localmente en adherencias infiltrantes en pacientes con endometriosis, correlacionando el aumento con intensidad del dolor (Rocha et al., 2011; Bohonyi et al., 2017). Esto no es sorprendente, ya que varios de los procesos responsables de la regulación positiva y la sensibilización de TRPV1 se encuentran en pacientes con endometriosis, incluidas concentraciones mejoradas de ROS y niveles aumentados de neurotrofinas como NGF. Juntos, estos mecanismos tienen la capacidad de activar TRPV1 y aumentar su expresión, impulsando aún más la sensibilización de los nociceptores periféricos (Wang, 2008; Ma et al., 2009; Kajihara et al., 2011). Se ha propuesto que la sensibilización crónica de las fibras nerviosas sensoriales periféricas a su vez induce la sensibilización del SNC en la endometriosis (Berkley et al., 2005; Arnold et al., 2012).
Estudios recientes también muestran que la exposición al estrés crónico temprano en la vida puede aumentar la probabilidad de DPC más adelante en la vida, mientras que los ataques de estrés agudo pueden desencadenar o empeorar los síntomas (Pierce et al., 2014, 2015; Pierce y Christianson, 2015; Fuentes y Christianson , 2018).
Sensibilización central
También se ha demostrado que la hiperexcitabilidad crónica de las aferencias periféricas induce cambios a largo plazo en la señalización del SNC, así como un aumento del brote de terminales centrales dentro del asta dorsal de la médula espinal en otros trastornos viscerales dolorosos, incluyendo IBS y cistitis intersticial (Harrington et al., 2012; Grundy et al., 2018, 2019). Estas condiciones contribuyen a la sensibilización de las neuronas en el SNC que produce una hiperexcitabilidad duradera en ausencia de estímulos nocivos (Anaf et al., 2006; Schulke et al., 2009).
Se cree que el incremento nociceptivo persistente de las lesiones endometrióticas inflamatorias conduce a una sensibilización central duradera de las aferencias sensoriales (Figura 1) (Bajaj et al., 2003). Este fenómeno se ha observado en pacientes con dolor crónico relacionado con osteoartritis, latigazo cervical (Koelbaek Johansen et al., 1999) y fibromialgia (Harris et al., 2009) y a menudo se considera la causa de dolor crónico `` inexplicable '' (Nijs et al. ., 2011).
La sensibilización central puede evocar cambios a largo plazo en el procesamiento del dolor, similar a la generación de 'memoria'. La irritación neonatal de los órganos huecos o la separación materna pueden impulsar la hipersensibilidad visceral / somática a largo plazo y la sensibilización central (Pierce et al., 2014). , 2015; Fuentes y Christianson, 2018).
La sensibilización central también se inicia y mantiene a menudo mediante la sensibilización periférica, lo que provoca que el dolor persista mucho después de la lesión o patología periférica o se haya resuelto (Tabla 2) (Woolf, 2011). Esto puede ser particularmente relevante en la endometriosis, ya que muchas mujeres experimentan dolor persistente a pesar del tratamiento o la extirpación de las lesiones endometriales (Shakiba et al., 2008; Li et al., 2018).
Además, las mujeres con dismenorrea (dolor menstrual) han aumentado la activación del SNC a estímulos nocivos en comparación con las mujeres que no experimentan dolor menstrual, un fenómeno que se observa en varias etapas del ciclo menstrual (Vincent et al., 2011).
En consecuencia, la sensibilización central de las vías del dolor podría ayudar a explicar por qué el dolor crónico persiste en algunos pacientes después de la extirpación de la lesión o por qué las puntuaciones de las lesiones diagnosticadas no se correlacionan con la intensidad del dolor (Li et al., 2018).
Teniendo esto en cuenta, la ubicación de las lesiones y su proximidad a los principales nervios periféricos pueden proporcionar una contribución importante pero pasada por alto al desarrollo del dolor crónico en pacientes diagnosticadas con endometriosis.
La neuroimagen se ha utilizado para identificar cambios crónicos en el cerebro de mujeres con DPC, tanto con endometriosis como sin ella. Se ha identificado una disminución del volumen de materia gris en áreas del cerebro relacionadas con el procesamiento del dolor, incluidos el tálamo y la ínsula, una región del cerebro que se activa constantemente durante los estados de dolor agudo y crónico (As-Sanie et al., 2016). Estos cambios se observaron en mujeres con endometriosis que experimentan DPC pero no en mujeres asintomáticas, lo que respalda aún más la función del procesamiento del dolor del SNC en la DPC. Además, la espectroscopia de resonancia magnética de protones determinó que las mujeres con endometriosis tenían niveles aumentados de neurotransmisores excitadores en su ínsula anterior en comparación con las mujeres sanas (As-Sanie et al., 2016). Usando un modelo animal de endometriosis, también se observaron cambios en la expresión génica en áreas similares del cerebro que procesan el dolor, incluidas la amígdala, la ínsula y el hipocampo (Li et al., 2018).
La sensibilización central no solo altera la respuesta al dolor del área de la agresión, sino que también puede alterar el dolor de áreas aparentemente no relacionadas.
Los modelos animales de endometriosis experimentan alodinia e hiperalgesia a diferentes estímulos nocivos, incluido el calor y la distensión vaginal (Nagabukuro y Berkley, 2007; McAllister et al., 2009; Li et al., 2018).
Del mismo modo, una cohorte de los pacientes con endometriosis experimentaron un aumento del dolor muscular después de la inyección de solución salina en la mano en comparación con los participantes sanos (Bajaj et al., 2003). En estos escenarios, tanto la hiperalgesia como la alodinia son evidentes una vez que se aplica un estímulo, lo que permite que los cambios en la sensibilización se hagan evidentes. Aunque se ha demostrado un aumento de las respuestas al dolor en estudios tanto en animales como en humanos, los cambios en la vía del SNC, junto con los mecanismos moleculares subyacentes a la sensibilización central en la endometriosis, son más difíciles de determinar.
Aunque se han informado cambios en el procesamiento central del dolor en la endometriosis, no está claro si exacerban la DPC después de los cambios iniciados por la endometriosis, o si estas mujeres ya están sensibilizadas y tienen una mayor respuesta a la enfermedad endometrial. Como la demora entre el inicio del dolor y el diagnóstico y tratamiento de la endometriosis es típicamente de ocho a 12 años, existe una amplia oportunidad para que estas lesiones induzcan los cambios crónicos necesarios para inducir la sensibilización central.
Aunque actualmente se desconoce si el diagnóstico temprano y la remoción de las lesiones podría revertir o evitar estos cambios en los pacientes, la remoción de las lesiones en las primeras etapas de progresión en modelos animales revirtió el dolor experimentado (McAllister et al., 2009, 2012), mientras que eliminarlos en etapas posteriores no tuvo ningún efecto (McAllister et al., 2012).
Sensibilización de órganos cruzados
Las mujeres con endometriosis tienen una alta tasa de comorbilidad con otros síndromes de dolor crónico asociados con cambios periféricos y centrales en el procesamiento del dolor, que incluyen fibromialgia, migrañas, SII y síndrome de vejiga dolorosa (Chung et al., 2002).
El fenómeno de sensibilización de órganos cruzados, descrito como la propagación de entradas nocivas de un órgano visceral enfermo a un órgano normal en las proximidades, se ha estudiado en otras afecciones patológicas en las que las comorbilidades son comunes, como el SII, la EII, la cistitis intersticial y otras CPP. trastornos (Wesselmann, 2001; Winnard et al., 2004, 2006; Pezzone et al., 2005; Grundy y Brierley, 2018).
Se han observado pruebas experimentales de sensibilización funcional cruzada de órganos en la pelvis en muchas combinaciones, que incluyen vejiga / colon (Qin et al., 2005; Grundy et al., 2018), vagina / colon, vejiga / útero (Ge et al. , 2019) y útero / colon (Lamb et al., 2006; Winnard et al., 2006). Por ejemplo, la inflamación uterina produjo signos de inflamación en el colon y la vejiga (Winnard et al., 2004), mientras que se ha encontrado que la inflamación de la vejiga altera la contractilidad uterina (Dmitrieva et al., 2001).
Estas alteraciones se han mostrado en modelos de endometriosis preclínicos en los que el crecimiento anormal del tejido endometrial indujo hiperalgesia vaginal en una rata, que fue exacerbada por el estradiol (Berkley et al., 2007; Nagabukuro y Berkley, 2007). También se ha demostrado que la endometriosis aumentó los comportamientos de dolor de ratas con cálculos renales, otra comorbilidad de mujeres con endometriosis (Giamberardino et al., 2002), y redujo el umbral de micción de ratas, lo que indica un aumento de la urgencia y frecuencia urinaria, un síntoma clínico de trastornos de la vejiga (Chung et al., 2002; Berkley, 2005).
Se cree que la sensibilización de órganos cruzados ocurre cuando las aferentes sensibilizadas de un órgano inducen la sensibilización de las aferentes
inervando otro órgano (Tabla 2 y Figura 2). Las aferencias viscerales convergen en áreas similares de la médula espinal, lo que brinda la oportunidad de sensibilizar las células vecinas debido a la ubicación espacial (Grundy et al., 2018; Ge et al., 2019).
Los mecanismos precisos responsables de la sensibilización de órganos cruzados no están claros; sin embargo, la superposición de las vías aferentes periféricas dentro del GRD y la médula espinal es crucial (Aredo et al., 2017; Grundy y Brierley, 2018; Grundy et al., 2019). Después de la neuroangiogénesis, que incluye la presencia de fibras nerviosas que expresan CGRP, TRPV1 y TRPA1 (Fattori et al., 2020), los nervios sensoriales que inervan las lesiones endometrióticas pueden converger en las mismas vías espinales de los aferentes de los que originalmente brotaron en la periferia. Como tales, compartirán los mismos cuerpos celulares en el GRD y las mismas terminales centrales dentro de la médula espinal (Costa et al., 2004). Dado que la ubicación de las lesiones ectópicas parece ser aleatoria, esto podría ayudar a explicar por qué la experiencia del dolor es heterogénea dentro de una población con endometriosis.
Dado que la menstruación retrógrada es la teoría principal para el desarrollo de la endometriosis, las lesiones pélvicas a menudo se encuentran alrededor del tracto reproductivo, con lesiones extrapélvicas muy próximas, ubicadas con frecuencia en el tracto gastrointestinal y el sistema urinario (Matalliotakis et al., 2017).
El dolor de estas lesiones más distantes a menudo imita el dolor de las lesiones pélvicas y la extensión de la enfermedad sigue siendo independiente de la gravedad de los síntomas, independientemente de la ubicación de la lesión. El mapeo consciente del dolor de las mujeres con endometriosis confirmó que la mitad de las participantes localizaron su dolor en los sitios de la lesión, pero muchas mujeres describieron un dolor generalizado en la pelvis y el intestino, lo que indica una hipersensibilidad visceral generalizada y un dolor independiente de la ubicación de la lesión (Howard et al., 2000; Hsu et al., 2011).
La palpación de varios tipos de lesiones durante la laparoscopia de mujeres con endometriosis también vio cómo el dolor se extendía al tejido de aspecto normal (Demco, 1998), mientras que se informó dolor referido en la mitad de las mujeres bajo sedación consciente durante la laparoscopia para DPC (Demco, 2000). El dolor específico de la lesión en los órganos viscerales puede explicarse por la neuroangiogénesis en las lesiones que convergen con las vías neuronales existentes en el órgano adherido, lo que promueve la sensibilización entre órganos debido a las vías nerviosas compartidas.
La sensibilización de órganos cruzados también puede ocurrir a través de vías de inervación compartidas de órganos anatómicamente distintos. Estudios recientes han demostrado que un solo cuerpo de células neuronales periféricas ubicado dentro del GRD es capaz de generar múltiples axones que inervan varios órganos abdominales simultáneamente (Christianson et al., 2007; Chaban, 2008; Jobling et al., 2010).
A menudo denominadas "aferentes dicotomizantes", estas fibras nerviosas convergen desde múltiples órganos viscerales a un solo cuerpo celular dentro del GRD y, por lo tanto, terminan en las mismas neuronas espinales de segundo orden. Si bien la evolución de estos aferentes dicotomizantes está incrustada dentro de la coordinación fisiológica de la función sexual, defecatoria y urinaria, la sensibilización de estas vías en condiciones patológicas puede permitir que se produzca la sensibilización entre órganos. El rastreo retrógrado ha revelado que estas neuronas co-inervan varios órganos pélvicos, incluido el colon / vejiga (Christianson et al., 2007; Grundy et al., 2018), colon / vagina (Ge et al., 2019) y colon / útero (Chaban, 2008; Broad et al., 2009).
Dolor en la endometriosis
La hipersensibilidad crónica generalizada en los órganos viscerales puede ser en parte el resultado de la sensibilización de órganos cruzados. El tracto reproductivo femenino está inervado por vías nerviosas esplácnicas, pélvicas y pudendo, lo que presenta una oportunidad para la relación cruzada a través de vías neuronales compartidas de otros órganos cercanos, como la vejiga y el intestino. Si bien el desarrollo de los nervios dentro de las lesiones ha sido de interés, comprender mejor el camino que toman los nuevos nervios y los cambios que facilitan es un paso necesario para interpretar la progresión del dolor en pacientes con endometriosis.
TRATAMIENTOS ACTUALES
80 % de los pacientes con endometriosis sufren de DPC, y la subfertilidad afecta al 60% de estas mujeres.
Aunque ambos síntomas son frecuentes, su tratamiento suele ser independiente y los planes reproductivos complican los regímenes de tratamiento óptimos. Dado que hasta el 87% de las mujeres que presentan DPC tienen endometriosis (Falcone y Flyckt, 2018), el tratamiento de la DPC es una estrategia eficaz para mejorar la calidad de vida de estas pacientes, independientemente de la subfertilidad.
En general, las opciones terapéuticas actuales proporcionan alivio del dolor durante más de seis meses en sólo 40 a 70% de los pacientes (Howard, 2000; Guo, 2009). Como tal, es necesaria una mayor comprensión de los mecanismos subyacentes al dolor inducido por endometriosis para lograr mejores resultados clínicos en el futuro.
Como se mencionó brevemente anteriormente, los tratamientos tradicionales se enfocan en las lesiones como causa de la DPC asociada con la endometriosis (Tabla 2).
Se sabe que la modulación de la señalización hormonal a través de agonistas de la hormona liberadora de gonadotropina (GnRH), inhibidores de la aromatasa y píldoras anticonceptivas orales suprime los síntomas del dolor mediante la inhibición de los estrógenos y la prevención de la menstruación.
Sin embargo, su incompatibilidad con la fertilidad las convierte en una opción de tratamiento a corto plazo para muchas mujeres, y la conclusión del tratamiento ve el regreso de la menstruación y los síntomas (Kitawaki et al., 2002; Guo, 2009; Slopien y Meczekalski, 2016). Al reducir la disponibilidad de estrógenos, la enfermedad dependiente de estrógenos se reduce significativamente y se elimina el sangrado cíclico. Aunque inicialmente fue efectivo, sólo se observó alivio del dolor en 40 a 70% de los pacientes después de 6 meses (Howard, 2000). Junto con los efectos secundarios hipoestrogénicos, incluida la pérdida de densidad mineral ósea y la osteoporosis secundaria, los cambios de humor y la atrofia mamaria (Kim et al., 2011), el uso de GnRH está aprobado por solo 6 meses. Además, las píldoras anticonceptivas no son viables durante el embarazo, lo que las convierte en una solución a corto plazo para muchas mujeres, especialmente aquellas con planes reproductivos.
Los inhibidores de la aromatasa inhiben la producción de estrógenos extraováricos, lo que los hace particularmente relevantes para las mujeres posmenopáusicas o en combinación con agonistas de GnRH; sin embargo, su reducción del dolor se ve nuevamente compensada por efectos secundarios adversos, que incluyen osteoporosis y fracturas óseas (Slopien y Meczekalski, 2016). ).
Los agentes analgésicos no hormonales, como los antiinflamatorios no esteroideos (AINE) y los analgésicos potentes (opioides), reducen la inflamación y enmascaran el dolor (Brown et al., 2017).
Los AINE se utilizan para combatir la inflamación, aunque una revisión de su eficacia para controlar el dolor causada por la endometriosis no es concluyente (Brown et al., 2017). Desafortunadamente, también se ha observado que los AINE a menudo son ineficaces y presentan toxicidad (Allen et al., 2005).
La terapia con opioides también se usa para tratar el dolor crónico asociado con la endometriosis y la intervención quirúrgica (Lamvu et al., 2019). Si bien los opioides brindan manejo del dolor, su efectividad en el tratamiento de la endometriosis no se comprende de manera confiable. El mal uso y el abuso es un problema creciente entre muchas condiciones de dolor crónico, junto con la tolerancia y la adicción que hacen de los opioides una opción de tratamiento indeseable (Kanouse y Compton, 2015). Desafortunadamente, aunque estos medicamentos representan un plan de tratamiento relativamente no invasivo, carecen de eficacia o dan como resultado tolerancia, dependencia y adicción.
Como la opción más invasiva, pero a menudo necesaria debido a la naturaleza debilitante del dolor crónico (Kanouse y Compton, 2015) y el tratamiento de la subfertilidad asociada a la endometriosis, el tratamiento quirúrgico de la endometriosis se basa en el principio de eliminar todas las lesiones endometriósicas para aliviar los síntomas. Si bien las lesiones endometriales dentro del peritoneo pueden extirparse o fulgurarse, a menudo vuelven a crecer debido a la menstruación retrógrada continua y la progresión de la enfermedad, y en muchos casos se necesita cirugía adicional (Cheong et al., 2008).
Entre el 20 y el 28% de los pacientes no responden a la cirugía (Sutton et al., 1994; Abbott et al., 2004), mientras que la recurrencia es tan alta como el 40-50% a los 5 años de la cirugía (Shakiba et al. , 2008). La extirpación quirúrgica de las lesiones a veces puede resultar un desafío según la etapa y el grado de la endometriosis, lo que complica aún más los resultados. La extirpación quirúrgica de las lesiones endometriales infiltrantes profundas reduce la DPC endometrial, pero se asocia con tasas de complicaciones significativas, que requieren una cirugía compleja para extirpar las lesiones, con resección del intestino, daño a la pared de la vejiga y colocación de endoprótesis en el uréter a menudo (Wee-Stekly et al. ., 2015).
Las tasas más bajas de cirugía adicional para el manejo del dolor son después de la histerectomía completa, con más del 90% de las pacientes que permanecen sin cirugía de seguimiento hasta por 7 años, aunque la extirpación de los ovarios y el útero no es tan efectiva en mujeres más jóvenes. (Shakiba et al., 2008). Además, los riesgos para la salud asociados debido a la menopausia precoz y la incompatibilidad con el embarazo hacen que la histerectomía sea un tratamiento inviable para muchas mujeres en edad reproductiva (Shakiba et al., 2008).
Incluso con una combinación de terapias, rara vez es posible la erradicación completa del dolor asociado al endometrio. Si bien las terapias actuales tienen como objetivo suprimir el dolor y retrasar la reaparición, la enfermedad a menudo se manifiesta una vez que los tratamientos se han detenido o las lesiones se han reformado. Si bien no es probable la erradicación completa de las lesiones, una mayor comprensión del dolor crónico asociado con la endometriosis y la identificación de posibles objetivos para el manejo del dolor pueden ayudar a mejorar la calidad de vida de quienes padecen endometriosis.
¿Terapias futuras? Perspectivas de modelos animales de endometriosis
Actualmente, la endometriosis se considera una enfermedad inflamatoria, con un tratamiento no quirúrgico dirigido a la prevención de la menstruación y terapia hormonal para limitar la progresión de la enfermedad y la inflamación. Cada vez es más evidente que esta enfermedad hay una naturaleza multifacética con el 40% de las mujeres que experimentan dolor pélvico no cíclico, por lo que limitar el tratamiento de la endometriosis al control antiinflamatorio u hormonal de la menstruación parece no dar en el blanco.
Actualmente, el retraso en el diagnóstico permite una progresión compleja de la enfermedad, lo que aumenta la oportunidad de que se produzcan cambios a largo plazo en el procesamiento del dolor. Aunque se ha avanzado en el diagnóstico y la clasificación de la endometriosis, la asistencia en el diagnóstico temprano sigue siendo importante. Las prioridades de investigación recientes para la endometriosis incluyen un énfasis en biomarcadores e imágenes para técnicas de diagnóstico no invasivas (Rogers et al., 2017). A pesar de múltiples estudios dirigidos a identificar un biomarcador confiable como herramienta de diagnóstico clínico, una revisión sistemática de los últimos 25 años concluyó que ningún biomarcador fue confirmado como clínicamente útil (May et al., 2010).
Sorprendentemente, también se ha observado que se ha avanzado muy poco en la comprensión del dolor crónico asociado con la endometriosis y se carece de avances posteriores en el tratamiento (Rogers et al., 2017).
La modulación del dolor a nivel de canal iónico y la orientación de receptores de dolor específicos en los sitios de lesión u órganos involucrados en la sensibilización de órganos cruzados pueden proporcionar un enfoque novedoso y no hormonal para pacientes con endometriosis que sufren de DPC (Castro et al., 2020). De hecho, limitar la neuroangiogénesis para prevenir la inervación y el crecimiento de la lesión, junto con la modulación directa de objetivos clave en los nervios periféricos, es una dirección importante para el manejo futuro de la CPP en la endometriosis. Con el respaldo de la evidencia de un modelo de endometriosis en ratones, la eliminación de la lesión en los puntos temporales tempranos reduce la CPP (McAllister et al., 2009, 2012; McKinnon et al., 2012). Pero en muchos casos este enfoque no es posible, ya sea en el diagnóstico tardío, la eliminación incompleta de la lesión o las lesiones infiltrantes profundas, está claro que la eliminación completa de la lesión en un momento temprano es una empresa difícil.
Los modelos animales de endometriosis han demostrado nuevos mecanismos para reducir la DPC. Esto incluye el uso de antagonistas del receptor de estrógeno EP2 para reducir la hiperalgesia primaria en un 80% y la hiperalgesia secundaria en un 40% en un modelo de endometriosis en ratones (Greaves et al., 2014). Además, los antagonistas del receptor 2 de bradicinina pueden bloquear la producción de endotelina-1 inducida por bradicinina, lo cual es importante ya que la endotelina-1 provoca sensibilización neuronal (Yoshino et al., 2018). Otros estudios han demostrado un papel clave para GPR30, un receptor de estrógeno acoplado a proteína G, en el dolor asociado a la endometriosis, por el cual los agonistas de GPR30 intralesión producen hiperalgesia mecánica persistente, mientras que los antagonistas de GPR30 inhiben la hiperalgesia mecánica (Alvarez et al., 2014). Por el contrario, la activación del receptor de cannabinoides tipo 1 (CB1R), que se expresan por las neuronas sensoriales y simpáticas que inervan las lesiones endometriales, disminuye la hiperalgesia asociada a la endometriosis (Dmitrieva et al., 2010). Además, los antagonistas de CB1R aumentan la hiperalgesia asociada a la endometriosis, lo que sugiere un tono cannabinoide endógeno (Dmitrieva et al., 2010). Estudios más recientes muestran que el tetrahidrocannabinol (THC) alivia la hipersensibilidad mecánica y el dolor en un modelo de ratón de endometriosis inducida quirúrgicamente. El THC también restauró la función cognitiva e inhibió el desarrollo de quistes endometriales (Escudero-Lara et al., 2020). Estos estudios sugieren que CB1R juega un papel crucial en el crecimiento de las lesiones y el dolor asociado a la endometriosis.
Estudios recientes también han sugerido el potencial de reutilizar tratamientos para otras afecciones. Esto incluye la reutilización del dicloroacetato, un inhibidor de la piruvato deshidrogenasa quinasa (PDK) / activador de la PDH que se usa para tratar el cáncer. Esto se debe a que el dicloroacetato normaliza el metabolismo de las células mesoteliales peritoneales humanas, reduce las concentraciones de lactato y la proliferación de células del estroma endometrial en un modelo de células de cocultivo. En un modelo de ratón de endometriosis, la administración oral de dicloroacetato reduce las concentraciones de lactato en el líquido peritoneal y el tamaño de la lesión endometrial (Horne et al., 2019).
Se han utilizado modelos animales de otras afecciones de dolor crónico, como IBS, para demostrar con éxito la modulación del dolor dirigiéndose a la periferia. Por ejemplo, el tratamiento crónico con un agonista de guanilato ciclasa-C (GC-C) (Linaclotide) revirtió los cambios neuroplásticos que causan tanto hipersensibilidad colónica como sensibilización de órganos cruzados de la vejiga en un modelo de ratón de IBS (Grundy et al., 2018). Más recientemente, el mismo agonista, cuyo objetivo directo GC-C se expresa dentro del tracto gastrointestinal, se ha utilizado para reducir la hiperalgesia vaginal y la alodinia en un modelo de endometriosis en ratas (Ge et al., 2019). Esto da lugar a la idea de que el dolor dirigido a un área puede de hecho reducir el dolor de otros órganos y que los cambios crónicos debidos a un área de lesión en un órgano pueden, de hecho, modular el dolor experimentado en otro.
El uso de modelos animales de endometriosis proporciona un medio importante para explorar el uso de medicamentos existentes para el tratamiento del dolor asociado con la endometriosis y debe continuar utilizándose.
Esta revisión proporciona evidencia de una heterogeneidad general en la endometriosis, en lugar de un enfoque de "talla única". Esto sugiere fuertemente un enfoque de tratamiento personalizado basado en la etiología y la sintomatología. Cambiar el paradigma del dolor inflamatorio cíclico y específico de la lesión seguirá abriendo más áreas para ampliar las oportunidades de tratamiento. La utilización de modelos animales de endometriosis que recapitulan de cerca la enfermedad humana brindará una oportunidad valiosa para estudiar más a fondo la progresión de la enfermedad y el dolor crónico. Con el desarrollo de modelos animales de endometriosis que ya brindan información de calidad sobre la progresión de la enfermedad y los mecanismos de tratamiento actuales, el siguiente paso es profundizar un poco más y dilucidar los cambios específicos de la enfermedad y sus objetivos en los niveles de lesión, GRD, médula espinal y cerebro.
Resumen con gráficas
Gráfica 1. Descripción esquemática de una respuesta inmune que conduce a dolor pélvico crónico en la endometriosis.
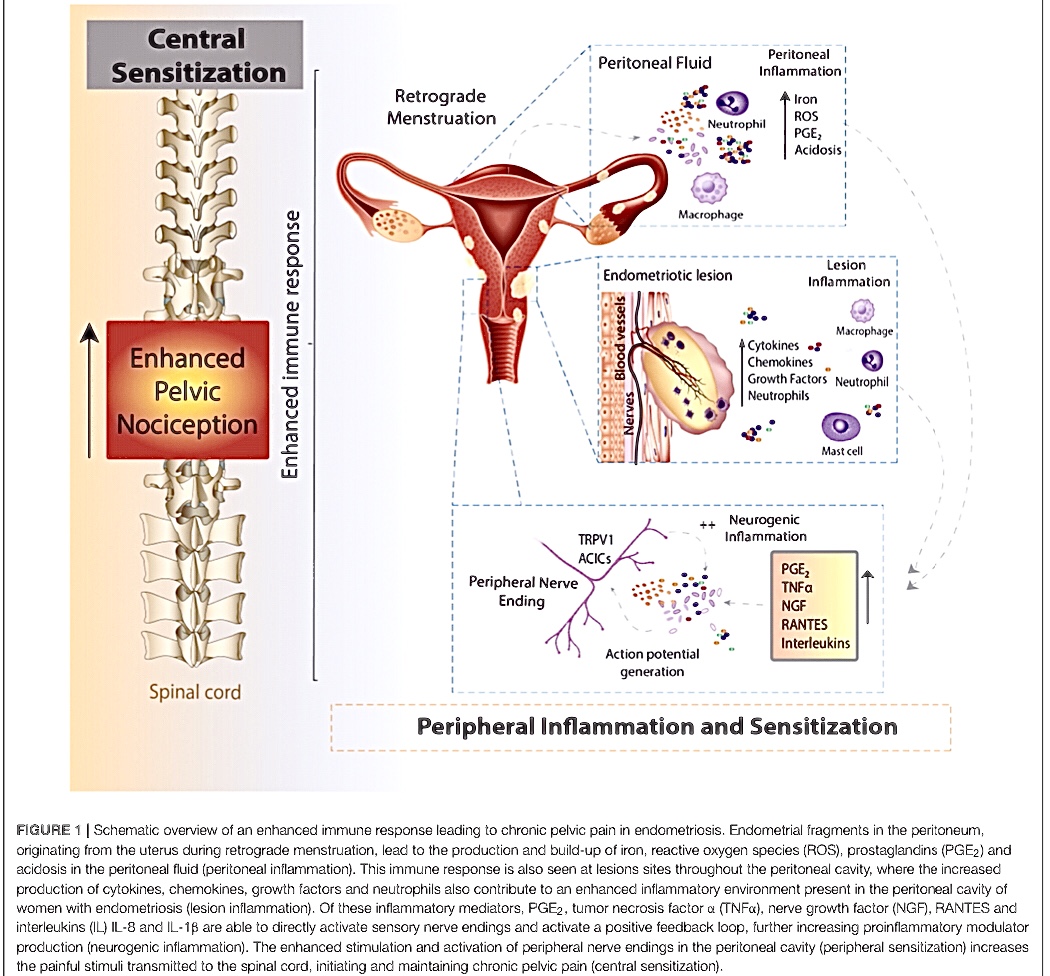
Los fragmentos de endometrio en el peritoneo, que se originan en el útero durante la menstruación retrógrada, conducen a la producción y acumulación de hierro, Especies reactivas de oxígeno (ROS), prostaglandinas (PGE2) y acidosis en el líquido peritoneal (inflamación peritoneal).
Esta respuesta inmune también se observa en los sitios de las lesiones en toda la cavidad peritoneal, donde el aumento de la producción de citocinas, quimiocinas, factores de crecimiento y neutrófilos también contribuye a un entorno inflamatorio mejorado presente en la cavidad peritoneal de las mujeres con endometriosis (inflamación de la lesión).
De estos mediadores inflamatorios, PGE2, factor de necrosis tumoral α (TNFα), factor de crecimiento nervioso (NGF), RANTES e interleucinas (IL) IL-8 e IL-1β son capaces de activar directamente las terminaciones nerviosas sensoriales y activar un circuito de retroalimentación positiva, aumentar aún más la producción de moduladores proinflamatorios (inflamación neurogénica).
La mayor estimulación y activación de las terminaciones nerviosas periféricas en la cavidad peritoneal (sensibilización periférica) aumenta los estímulos dolorosos transmitidos a la médula espinal, iniciando y manteniendo el dolor pélvico crónico (sensibilización central).
Gráfica 2. Descripción esquemática de la inervación sensorial del colon, la vejiga y el útero / vagina que permite la sensibilización de órganos cruzados.

El colon está inervado por aferentes espinales dentro de las vías esplácnicas y pélvicas. Estos aferentes espinales pueden viajar a través de los nervios esplácnicos o pélvicos (con algunos aferentes atravesando el nervio hipogástrico) y tienen cuerpos celulares ubicados dentro de los ganglios de la raíz dorsal toracolumbar y lumbosacra (GRD).
La vejiga también está inervada por vías esplácnicas y pélvicas (de Groat et al., 2015). Las terminales centrales de las aferencias vesicales y del colon terminan dentro del asta dorsal del asta dorsal toracolumbar y lumbosacro (Harrington et al., 2012, 2019; Grundy et al., 2018).
Las aferentes que inervan el útero y la vagina también comparten las vías esplácnica y pélvica, mientras que la vagina también está inervada por los nervios pudendos, con cuerpos celulares dentro del GRD lumbosacro y terminales centrales dentro del asta dorsal lumbosacro (Berkley, 2005).
Las terminales centrales del colon, la vejiga, el útero y las aferencias vaginales hacen sinapsis con las neuronas del asta dorsal de segundo orden en la médula espinal, que finalmente transmiten señales al cerebro.
En consecuencia, estos diferentes órganos viscerales comparten vías nerviosas comunes al GRD y la médula espinal, lo que permite la posibilidad de sensibilización entre órganos. TL, toracolumbar; LS, lumbosacro; IMG, ganglio mesentérico inferior; MPG, ganglio pélvico mayor.

TABLA 1 | Enfoques actuales para DPC en endometriosis.
Clase
Hormonal:
Agonistas de GnRH, Inhibidores de aromatasa
Píldora anticonceptiva
Mecanismo: Modulación de la señalización hormonal y prevención de la menstruación.
Efectos secundarios: Hipoestrogénico: disminución de la densidad ósea, cambios de humor y atrofia mamaria
No viable con el embarazo
No hormonal: Aines, opioides
Mecanismo:Se dirige a la inflamación
Efectos secundarios: A menudo ineficaz, Exhibir toxicidad, Tolerancia, dependencia, estreñimiento y adicción
Quirúrgico: Escisión o ablación de lesiones
Histerectomía parcial o completa
Mecanismo: Lesiones diana o útero como sitio de endometriosis
Efectos secundarios: Cirugía invasiva con tasas de complicaciones significativas, Menopausia precoz, No siempre es viable durante el embarazo (histerectomía)
TABLA 2 |
Mecanismos del dolor en la endometriosis.
Inflamación
Sitio: Líquido peritoneal y lesiones endometriales.
Mecanismo: Menstruación retrógrada y sangrado cíclico en los sitios de lesión
Claves: La activación de una respuesta inmune innata aumenta las citocinas / quimiocinas inflamatorias y nociceptivas (interleucinas TNFα IL-8 e IL-1β) (Barcz
et al., 2000), ROS, factores de crecimiento (NGF y VEGF) (Donnez et al., 1998), neutrófilos y prostaglandinas (PGE2) (Sacco et al., 2012; Králíèková y Vetvicka, 2015)
Inflamación neurogénica
Sitio: Nervios sensoriales
Mecanismo: La acumulación de entorno pronociceptivo puede actuar directamente sobre las fibras nerviosas sensoriales
Claves: Los subproductos tisulares degradados, incluidos ROS, PGE2 y acidificación, pueden activar los nervios sensoriales (Reeh y Steen, 1996; Holzer, 2011). El circuito de retroalimentación positiva mantiene la inflamación al liberar más moduladores proinflamatorios, incluidos SP y CGRP (Tokushige et al., 2006b).
Sensibilización periférica
Sitio: Nervios sensoriales periféricos
Mecanismo: Neuroplasticidad de los nervios sensoriales periféricos
Claves:La inflamación persistente puede provocar que se produzcan cambios estructurales y sinápticos para cambiar la función neuronal a un estado más sensibilizado (Brierley y Linden, 2014). La abundancia de moléculas inflamatorias en el líquido peritoneal, incluidas la glicodelina, ROS, TNFα, NGF y PGE2, pueden contribuir a esto (Chiu et al., 2012).
Sensibilización central
Sitio: Sistema nervioso central (SNC)
Mecanismo: Cambios a largo plazo en la señalización del SNC
Claves: El bombardeo nociceptivo persistente conduce a una sensibilización central duradera de las aferencias sensoriales, lo que evoca cambios a largo plazo en el procesamiento del dolor o la "memoria" (Bajaj et al., 2003; Woolf, 2011).
Sensibilización de órganos cruzados
Sitio: Aferentes sensibilizados en múltiples órganos
Mecanismo: Las aferencias sensibilizadas de un órgano inducen la sensibilización de las aferentes que inervan otro órgano.
Claves: Las aferencias viscerales convergen en áreas similares de la médula espinal proporcionando la oportunidad para la sensibilización de las células vecinas debido a la ubicación espacial (Ge et al , 2019)
https://www.intramed.net/contenidover.asp?contenidoid=96371
REFERENCIAS
Abbott, J., Hawe, J., Hunter, D., Holmes, M., Finn, P., and Garry, R. (2004). Laparoscopic excision of endometriosis: a randomized, placebo-controlled trial. Fertil. Steril. 82, 878–884. doi: 10.1016/j.fertnstert.2004.03.046
Adamson, G., Kennedy, S., and Hummelshoj, L. (2010). Creating solutions in endometriosis: global collaboration through the World Endometriosis Research Foundation. J. Endometr. 2, 3–6. doi: 10.1177/228402651000200102
Adamson, G. D. (2011). Endometriosis classification: an update. Curr. Opin. Obstet. Gynecol. 23, 213–220. doi: 10.1097/gco.0b013e328348a3ba
Allen, C., Hopewell, S., and Prentice, A. (2005). Non-steroidal anti-inflammatory drugs for pain in women with endometriosis. Cochrane Database Syst. Rev. 1:CD004753.
Alvarez, P., Bogen, O., and Levine, J. D. (2014). Role of nociceptor estrogen receptor GPR30 in a rat model of endometriosis pain. Pain 155, 2680–2686. doi: 10.1016/j.pain.2014.09.035
Amaral, V. F., Ferriani, R. A., Sa, M. F., Nogueira, A. A., Rosa, E., Silva, J. C., et al. (2006). Positive correlation between serum and peritoneal fluid CA-125 levels in women with pelvic endometriosis. Sao Paulo Med. J. 124, 223–227. doi: 10.1590/s1516-31802006000400010
Anaf, V., Chapron, C., El Nakadi, I., De Moor, V., Simonart, T., and Noel, J. C. (2006). Pain, mast cells, and nerves in peritoneal, ovarian, and deep infiltrating endometriosis. Fertil. Steril. 86, 1336–1343. doi: 10.1016/j.fertnstert.2006. 03.057
Anaf, V., El Nakadi, I., De Moor, V., Chapron, C., Pistofidis, G., and Noel, J. C. (2011). Increased nerve density in deep infiltrating endometriotic nodules. Gynecol. Obstet. Invest. 71, 112–117. doi: 10.1159/000320750
Anaf, V., Simon, P., El Nakadi, I., Fayt, I., Buxant, F., Simonart, T., et al. (2000). Relationship between endometriotic foci and nerves in rectovaginal endometriotic nodules. Hum. Reprod. 15, 1744–1750. doi: 10.1093/humrep/15. 8.1744
Anaf, V., Simon, P., El Nakadi, I., Fayt, I., Simonart, T., Buxant, F., et al. (2002). Hyperalgesia, nerve infiltration and nerve growth factor expression in deep adenomyotic nodules, peritoneal and ovarian endometriosis. Hum. Reprod. 17, 1895–1900. doi: 10.1093/humrep/17.7.1895
Aredo, J. V., Heyrana, K. J., Karp, B. I., Shah, J. P., and Stratton, P. (2017). Relating chronic pelvic pain and endometriosis to signs of sensitization and myofascial pain and dysfunction. Semin. Reprod. Med. 35, 88–97.
Arnold, J., Barcena De Arellano, M. L., Ruster, C., Vercellino, G. F., Chiantera, V., Schneider, A., et al. (2012). Imbalance between sympathetic and sensory innervation in peritoneal endometriosis. Brain Behav. Immun. 26, 132–141. doi: 10.1016/j.bbi.2011.08.004
Arruda, M. S., Petta, C. A., Abrao, M. S., and Benetti-Pinto, C. L. (2003). Time elapsed from onset of symptoms to diagnosis of endometriosis in a cohort study of Brazilian women. Hum. Reprod. 18, 756–759. doi: 10.1093/humrep/deg136
Asante, A., and Taylor, R. N. (2011). Endometriosis: the role of neuroangiogenesis. Annu. Rev. Physiol. 73, 163–182. doi: 10.1146/annurev- physiol- 012110- 142158 As-Sanie, S., Kim, J., Schmidt-Wilcke, T., Sundgren, P. C., Clauw, D. J., Napadow, V., et al. (2016). Functional connectivity is associated with altered brain chemistry in women with endometriosis-associated chronic pelvic pain. J. Pain
17, 1–13. doi: 10.1016/j.jpain.2015.09.008
Aziz, Q. (2013). Complementary alternative medicine and autonomic nervous
system and functional bowel disorders. Auton. Neurosci. 177, 42–43. doi: 10.
1016/j.autneu.2013.05.081
Bacci, M., Capobianco, A., Monno, A., Cottone, L., Di Puppo, F., Camisa, B., et al.
(2009). Macrophages are alternatively activated in patients with endometriosis and required for growth and vascularization of lesions in a mouse model of disease. Am. J. Pathol. 175, 547–556. doi: 10.2353/ajpath.2009.081011
Bajaj, P., Bajaj, P., Madsen, H., and Arendt-Nielsen, L. (2003). Endometriosis is associated with central sensitization: a psychophysical controlled study. J. Pain 4, 372–380. doi: 10.1016/s1526-5900(03)00720-x
Ballard, K. D., Seaman, H. E., De Vries, C. S., and Wright, J. T. (2008). Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study–Part 1. BJOG 115, 1382–1391. doi: 10.1111/j.1471- 0528.2008.01878.x
Banu, S. K., Lee, J., Speights, V. O. Jr., Starzinski-Powitz, A., and Arosh, J. A. (2008). Cyclooxygenase-2 regulates survival, migration, and invasion of human
endometriotic cells through multiple mechanisms. Endocrinology 149, 1180–
1189. doi: 10.1210/en.2007-1168
Barcz, E., Kaminski, P., and Marianowski, L. (2000). Role of cytokines in
pathogenesis of endometriosis. Med. Sci. Monit. 6, 1042–1046.
Basbaum, A. I., Bautista, D. M., Scherrer, G., and Julius, D. (2009). Cellular and
molecular mechanisms of pain. Cell 139, 267–284.
Bedaiwy, M. A., Falcone, T., Sharma, R. K., Goldberg, J. M., Attaran, M., Nelson,
D. R., et al. (2002). Prediction of endometriosis with serum and peritoneal fluid markers: a prospective controlled trial. Hum. Reprod. 17, 426–431. doi: 10.1093/humrep/17.2.426
Berbic, M., and Fraser, I. S. (2013). Immunology of normal and abnormal menstruation. Womens Health 9, 387–395. doi: 10.2217/whe.13.32
Berkley, K. J. (2005). A life of pelvic pain. Physiol. Behav. 86, 272–280.
Berkley, K. J., Mcallister, S. L., Accius, B. E., and Winnard, K. P. (2007). Endometriosis-induced vaginal hyperalgesia in the rat: effect of estropause, ovariectomy, and estradiol replacement. Pain 132(Suppl. 1), S150–S159.
Berkley, K. J., Rapkin, A. J., and Papka, R. E. (2005). The pains of endometriosis. Science 308, 1587–1589. doi: 10.1126/science.1111445
Bjorling, D. E., Beckman, M., Clayton, M. K., and Wang, Z. Y. (2002). Modulation of nerve growth factor in peripheral organs by estrogen and progesterone. Neuroscience 110, 155–167. doi: 10.1016/s0306-4522(01)00568-1
Bohonyi, N., Pohoczky, K., Szalontai, B., Perkecz, A., Kovacs, K., Kajtar, B., et al. (2017). Local upregulation of transient receptor potential ankyrin 1 and transient receptor potential vanilloid 1 ion channels in rectosigmoid deep infiltrating endometriosis. Mol. Pain 13:1744806917705564.




